Publications
-
上期(基于风险的药物警戒审计 - I),我们介绍了药物警戒审计的类型及目的,基于风险的药物警戒审计计划和常见的药物警戒检查发现等话题。本期,将从流程的角度,分享如何开展一个常规的药物警戒审计,以及审计流程中各个部分的基本考量。 ...
-
药物警戒审计(亦称 “内部审核”、“内审”、“稽查”)是质量管理的重要一环,是评估药物警戒体系及其质量体系的适宜性、充分性、有效性的重要方式1。审计人员独立于药物警戒部门之外,能更客观、系统、全面地审查药物警戒相关制度、规程及其执行情况。审计不仅可以发现质量问题,促进持续改进;同时也可以验证现有体系的适宜性、充分性和有效性,以保障全面符合相关法律法规的要求。 ...
-
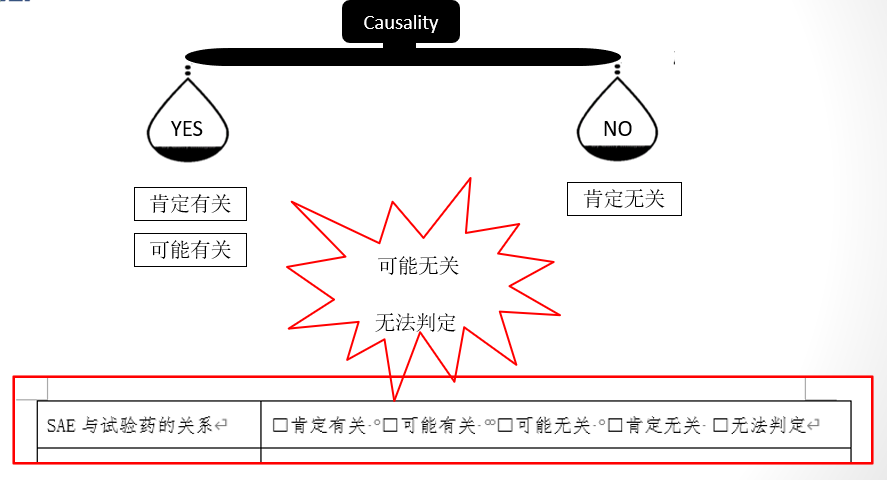
对于不良事件(AE)与药物之间的相关性判断,目前全球存在30多种判断规则以及不同的评判结果分类,并没有统一的标准。在国内的临床研究中,研究者习惯采用“5分法”记录和报告严重不良事件(SAE),而申办者需要判断事件是否符合“可疑且非预期严重不良反应(SUSAR)”,采用的是“2分法”。两种判断的异同和解决方案成为CQAF-PV工作组的第一期“PV线上小讨论”的主题(2022年3月30日)。本期小讨论由勃林格殷格翰的吴奕卿女士主持,邀请到上海市精神卫生中心机构办沈一峰主任,拜耳亚太区稽查负责人于桂琴女士和百济神州药物警戒高级总监张轶菁女士参与讨论。 ...
-
近年来,国家药品监管部门为管理和指导药物警戒工作相继出台了一系列法规。对于委托管理,《药物警戒质量管理规范》第二章第三节第十五条明确规定“持有人是药物警戒的责任主体,根据工作需要委托开展药物警戒相关工作的,相应法律责任由持有人承担”。本文从质量管理的角度出发,梳理持有人在委托管理各环节需考虑的要点,旨在为委托管理提供思路和启发。 ...
-
持续评估风险和获益:临床试验中重要信息的更新 ...
-
2017年10月27日国家食品药品监督管理总局发布了《药物临床试验机构管理规定(征求意见稿)》,今年CQAF第一季度会期间,会员们就该征求意见稿与现行法规的主要改变、对今后申办者和研究机构的影响等问题进行了讨论,讨论内容总结如下。 ...







 沪公网安备 31011202013414号
沪公网安备 31011202013414号